Справочник химика 21
Химия и химическая технология
Порядок заполнения электронами уровней и подуровней
Приведенные выше данные по строению электронных оболочек атомов позволяют сделать интересные заключения о связи между строением атома и периодической системой химических элементов. Последовательное заполнение электронных оболочек атомов электронами по мере возрастания порядкового номера элемента во втором и третьем периодах обусловливает собой заполнение прежде всего s- и затем р-состояний. Поэтому в этих периодах первые два элемента можно назвать s-элементами, а остальные шесть — р-элементами. В четвертом и пятом периодах порядок последовательного заполнения электронных оболочек атомов несколько иной. Если первые два элемента в каждом из этих периодов можно назвать -элементами, то последующие десять элементов следует назвать -элементами, поскольку в их атомах заполняется d-подуровень второго уровня, отсчитываемого снаружи оболочки атома, а затем уже заполняется о-подуро-вень внешнего уровня последние шесть элементов в каждом из этих периодов обычно называют s/7-элементами. Аналогичное имеет место в шестом и седьмом периодах, в атомах элементов которых, по сути дела, затюлиение электронных оболочек происходит в такой последовательности вначале заполняется s-подуровень внешнего уровня, затем /-подуровень третьего уровня, отсчитываемого снаружи оболочки и d-под-уровень второго уровня, отсчитываемого снаружи, и, наконец, р-подуровень внешнего уровня. Описанное здесь заполнение электронами электронных оболочек атомов в различных периодах не может не проявиться в периодических системах химических элементов, поскольку построение их, как и заполнение электронных оболочек, в конечном счете опирается на периодический закон. [c.72]
Учитывая порядок заполнения подуровней, число ячеек в каждом подуровне и то, что в каждой ячейке могут быть только 2 электрона, можно написать формулу состояний электронов для атома любого элемента. При этом надо руководствоваться положением этого элемента в периодической системе Д. И. Менделеева. Рассмотрим, например, атом бора. Бор является третьим элементом второго периода. В элементах первого периода (Н и Не) заполняется единственная ячейка ]5-под-уровня. В первых элементах второго периода (Ь1, Ве) заполняется ячейка 28-подуровня и в случае бора начинает заполняться 2р-подуро-вень. Поэтому формула энергетических состояний электронов атома бора будет 15 25 2р. Арабские цифры, стояш,ие перед буквами 5, р, f, обозначают энергетический уровень, к которому принадлежит соответст-вуюш,ий подуровень, т. е. являются главными квантовыми числами. Число электронов в подуровне указывается арабской цифрой в виде показателя степени. [c.85]
Порядок заполнения электронами электронных оболочек

Правила заполнения электронных оболочек и составление электронных конфигураций атомов
Правила заполнения электронных оболочек и составление электронных конфигураций атомов
Распределение электронов по атомным орбиталям (АО) происходит в соответствии с принципом наименьшей энергии, принципом Паули и правилом Гунда.
1. Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения их энергии: в первую очередь заполняются уровни и подуровни с наиболее низкой энергией и далее – подуровни по мере роста их энергии.
Это отражает общие термодинамические тенденции – максимуму устойчивости системы соответствует минимум её энергии. Самым низким по энергии, как уже говорилось, является первый, ближайший к ядру энергетический уровень с n = 1.
В многоэлектронных атомах электрон взаимодействует не только с ядром (электростатическое притяжение), но и с другими электронами (электро-статическое отталкивание). В этом случае его энергия определяется не только главным n, но и орбитальным l квантовыми числами. Орбитальное число определяет форму орбиталей, и чем сложнее их форма, тем выше энергия
подуровня который они составляют. Таким образом, при одном и том же значении n энергия возрастает с ростом l : ns ≈ \approx 4f ≈ \approx 5f ½ + ½ + ½ = 1 ½ . ½+½+½ = 1 ½.
Если бы электроны расположились так:
то суммарный спин был бы равен ½ – – ½ + + ½ = = ½.
Правило Гунда выведено на основании изучения атомных спектров.
Квантово-механическая природа этого правила основана на том, что электроны с разными значениями ml (в нашем примере – 1 ; –1; 0 0 ; + 1 +1 ) наиболее пространственно удалены друг от друга и энергия их электростатического отталкивания минимальна.
Как следствие, на одной орбитали не может находиться более двух элек-тронов. При этом их спины будут противоположными.
Все вышеизложенные правила определяют энергию электрона, электрон-ную конфигурацию атома и местоположение элемента в Периодической сис-теме Д.И. Менделеева.
Порядок заполнения электронами электронных оболочек
§2.6 Электронная конфигурация. Электронные формулы. Орбитальные диаграммы. Правило октета.
Наша задача — разобраться в том, как заполняются электронные уровни, подуровни и орбитали по мере усложнения атома.
Существует условное изображение электронных уровней и подуровней, называемое орбитальной диаграммой. На такой диаграмме орбитали условно изображаются квадратиками, а электроны — стрелочками. Если стрелочки направлены в разные стороны, это означает, что электроны различаются между собой особым свойством, которое назывется спином электрона. В данный момент для нас не важна суть этого свойства. Требуется лишь понимать, что электроны могут чем-то отличаться друг от друга.
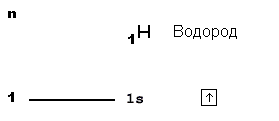
На схеме вверху вы видите орбитальную диаграмму атома водорода, у которого единственный электрон размещается на самом близком к ядру 1-м уровне. На этом уровне только одна s-орбиталь (на схеме она показана квадратиком). Собственно, квадратик с изображением внутри электрона-стрелочки и является орбитальной диаграммой.
Теперь рассмотрим атом гелия:
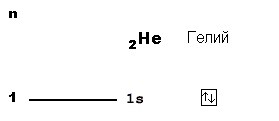
В атоме гелия (2 протона в ядре) уже два электрона, причем оба еще могут поместиться на 1-м уровне. Значит, «адрес» этих электронов такой же, как у водорода: 1s. Но чтобы показать, что здесь находится уже не 1, а 2 электрона, пишут “адрес” с указанием количества “жильцов”-электронов: 1s 2 . Эта короткая запись описывает электронное строение атома гелия. Поэтому такие записи называют электронными формулами. 1s 1 — электронная формула атома водорода. 1s 2 — электронная формула атома гелия.
Рассмотрим атом лития:

У него три протона в ядре, поэтому литий содержит в своем электронном облаке 3 электрона, для чего занимает электронами сначала весь 1-й уровень (там помещается только 2 электрона), а оставшийся электрон вынужден переместиться на более высокий 2-й уровень, где займет ближайшую к ядру свободную 2s-орбиталь. «Адрес» трех электронов этого элемента таков: 1s 2 2s 1 . Мы записали электронную формулу для лития.
Из этих простых примеров становится ясен принцип минимума энергии — при заполнении электронных оболочек в первую очередь заполняются более низкие, ближайшие к ядру уровни и подуровни.
На рис. 2-8 показана более подробная орбитальная диаграмма для первых электронных уровней большинства атомов.
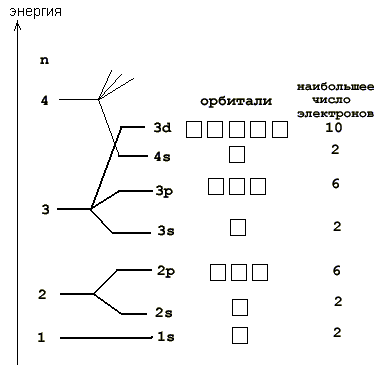
Рис. 2-8. Порядок заполнения орбиталей на первых, наиболее близких к ядру электронных уровнях в многоэлектронных атомах. Заполнение электронами происходит снизу вверх. Справа показано наибольшее количество электронов, способных разместиться на орбиталях данного подуровня. 4-й уровень показан не полностью.
Чем дальше от ядра располагаются уровни и подуровни, тем выше их энергия. Для атомов, у которых мало электронов (например, 3Li) уровни и подуровни распределяются по энергии вполне логично: 1s, затем 2s, 2p, затем 3s, 3p, 3d, затем 4s, 4p, 4d, 4f … и т.д. Правда, об этом редко вспоминают, потому что у «легких» атомов 3-й и 4-й уровни пусты. Но с возрастанием числа электронов в многоэлектронных атомах все электроны начинают заметно взаимодействовать не только с ядром, но и друг с другом. В частности, электроны нижних уровней «заслоняют» электроны верхних уровней от влияния ядра (в физике это называется экранированием). Чем дальше от ядра, тем меньше становится разница между соседними уровнями и подуровнями. В результате некоторые верхние подуровни начинают «наезжать» друг на друга. Уже в атоме углерода 6С (у него 6 электронов) 3d-подуровень оказывается чуть выше по энергии, чем 4s. Такие аномалии еще чаще встречаются на более высоких уровнях. Вот как выглядит порядок заполнения уровней и подуровней в многоэлектронных атомах (это атомы большинства элементов):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, .
Нет никакой необходимости запоминать эту последовательность. В главе 4 мы научимся легко извлекать ее из Периодической таблицы Д.И.Менделеева.
** Если говорить более строго, то относительное расположение подуровней обусловлено не столько их большей или меньшей энергией, сколько требованием минимума полной энергии атома. Исходя из этого требования, минимум энергии достигается у большинства атомов тогда, когда их подуровни заполняются в показанной выше последовательности. Но есть и исключения, которые вы можете найти в таблицах «Электронные конфигурации элементов» (см. меню слева). Однако эти исключения редко приходится принимать во внимание при рассмотрении химических свойств элементов.
Пользуясь рис. 2-8, мы можем приступить к заполнению электронных уровней атомов многих элементов. Как нам уже известно, атом каждого элемента содержит строго определенное число электронов, равное числу протонов в его ядре (то есть заряду ядра). Правила заполнения электронных оболочек следующие:
1. Сначала выясняем, сколько всего электронов содержит атом интересующего нас элемента. Для этого достаточно знать заряд его ядра, который, как мы увидим в главе 4, всегда равен порядковому номеру элемента в Периодической таблице Д.И.Менделеева. Порядковый номер (число протонов в ядре) в точности равен и числу электронов во всем атоме.
2. Последовательно заполняем орбитали, начиная с нижней 1s-орбитали, имеющимися электронами (рис. 2-8). При этом нельзя располагать на каждой орбитали более двух электронов.
3. Записываем электронную формулу элемента.
Электронная формула описывает распределение электронов по энергетическим уровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома.
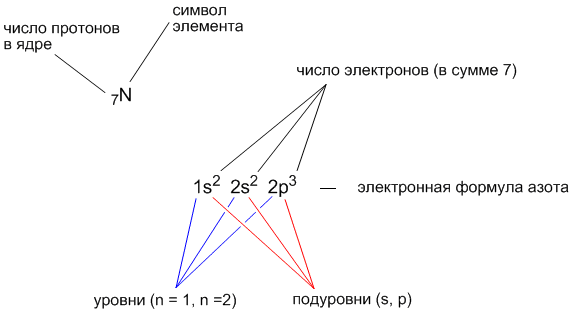
Запись электронной формулы проще показать на конкретном примере. Допустим, нам надо выяснить электронную формулу элемента с порядковым номером 7. В атоме такого элемента должно быть 7 электронов. Заполним орбитали семью электронами, начиная с нижней 1s-орбитали.
Итак, 2 электрона расположатся на 1s-орбитали, еще 2 электрона — на 2s-орбитали, а оставшиеся 3 электрона смогут разместиться на трех 2p-орбиталях.
Электронная формула элемента с порядковым номером 7 (это элемент азот, имеющий символ “N”) выглядит так:
Существует правило (оно называется правилом Гунда), по которому электроны предпочитают расселяться на одинаковых по энергии орбиталях (например, на трех p-орбиталях) сначала по одиночке, и лишь когда в каждой такой орбитали уже находится по одному электрону, начинается заполнение этих орбиталей вторыми электронами. Когда орбиталь заселяется двумя электронами, такие электроны называют спаренными.
Посмотрим действие правила Гунда на примере элемента азота (1s 2 2s 2 2p 3 ). На 2-м электронном уровне есть три одинаковых p-орбитали: 2p x, 2py, 2pz. Электроны заселят их так, что на каждой из этих p-орбиталей окажется по одному электрону. Объясняют это тем, что в соседних ячейках электроны меньше отталкиваются друг от друга, как одноименно заряженные частицы.
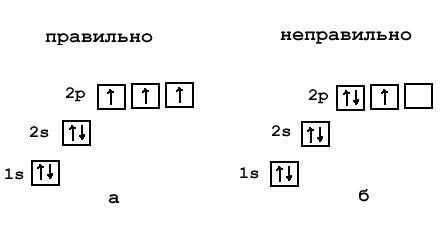
Рис. 2-9. Правильная (а) и неправильная (б) орбитальная диаграмма азота. В соответствии с правилом Гунда орбитали заселяются сначала одиночными, а не спаренными электронами.
По правилу Гунда при заполнении электронами одинаковых по энергии орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами.
Полученная нами электронная формула азота несет очень важную информацию: 2-й (внешний) электронный уровень азота заполнен электронами не до конца (на нем 2 + 3 = 5 электронов) и до полного заполнения не хватает трех электронов.
Внешним уровнем атома называется самый далекий от ядра уровень, на котором еще есть электроны. Именно эта оболочка соприкасается при столкновении с внешними уровнями других атомов в химических реакциях. При взаимодействии с другими атомами азот способен принять 3 дополнительных электрона на свой внешний уровень. При этом атом азота получит завершенный, то есть максимально заполненный внешний электронный уровень, на котором расположатся 8 электронов.
Завершенный уровень энергетически выгоднее незавершенного (о том, как это выяснилось, вы узнаете уже в этом параграфе). Поэтому атом азота должен легко реагировать с любым другим атомом, способным предоставить ему 3 дополнительных электрона для завершения его внешнего уровня.
Другой пример: элемент с порядковым номером 18. Действуя так же, как и в первом случае, мы с помощью рис. 2-8 расположим 18 электронов в следующую электронную формулу:
1s 2 2s 2 2p 6 3s 2 3p 6
Элемент с порядковым номером 18 — это аргон (знакомый нам по предыдущей главе). Он уже имеет полностью завершенный внешний уровень и, следовательно, не склонен реагировать с другими элементами. Действительно, химическое поведение аргона настолько выделяется своей пассивностью среди других элементов, что он получил название инертного газа или благородного газа (последнее, вероятно, за свою «химическую лень»). Аргон (в переводе с греческого «недеятельный») не реагирует ни с одним химическим элементом. В свободном состоянии он существует не в виде двухатомных молекул (как другие газы), а в виде отдельных атомов (вот мы и ответили на один из вопросов параграфа 2.1 этой главы!)
Инертность аргона такова, что до сих пор, несмотря на все попытки, не удалось получить ни одного его устойчивого соединения.
** Аргон является не единственным благородным или инертным газом. Существуют также элементы гелий (He, заряд ядра 2), что означает «солнечный» (впервые обнаружен на Солнце спектральными методами и только потом — в минерале клевеите); неон (Ne, «новый», заряд ядра 10); криптон (Kr, «скрытный», заряд ядра 36); ксенон (Xe, «странный», заряд ядра 54). Существует также радиоактивный благородный газ радон (Rn, заряд ядра 86), медленно выделяющийся из горных пород. Все эти газы в небольших количествах имеются в атмосфере.
Из-за своей химической инертности благородные газы долго не были известны химикам. Аргон был открыт первым благодаря наблюдательности английского ученого Джона Уильяма.Рэлея.
В 1892 году Рэлей столкнулся с загадочным фактом, который было трудно объяснить: газ азот, полученный из атмосферы, оказывался неизменно «тяжелее» азота, полученного путем его выделения из химических соединений. Если 1 л азота, полученного из воздуха, весил 1,2572 г, то 1 л азота, полученного разложением азотистых соединений, весил 1,2505 г !

Менее аккуратный исследователь либо не заметил бы такую маленькую разницу, либо отнес ее за счет погрешности измерений. Но Рэлей многократно повторил свои опыты и выяснил, что это не случайность. Вместе с другим британским ученым — Уильямом Рамзаем — он пришел к выводу, что в атмосферном азоте, очищенном от других известных газов, может скрываться какой-то новый, неизвестный ранее “тяжелый” газ.
Спустя два года они осуществили эксперимент по поглощению азота раскаленным магнием при пропускании искрового электрического разряда и выделили оставшийся в сосуде таинственный газ, который оказался в 20 раз тяжелее водорода. Это и был аргон.
Впоследствии У. Рамзай провел эксперименты по дробной перегонке жидкого воздуха и открыл еще три инертных газа: неон, ксенон и криптон. Гелий также впервые был выделен Рамзаем в опыте по обработке минерала клевеита горячей серной кислотой.
Многочисленные попытки химиков заставить благородные элементы вступать в химические реакции увенчались успехом лишь сравнительно недавно: начиная с 60-х годов известно несколько десятков соединений ксенона и криптона с наиболее «агрессивным» из всех химических элементов — фтором, а также с кислородом. Однако до сих пор неизвестно ни одного стабильного соединения гелия, неона и аргона. В 2000 г. появилось сообщение о получении гидрофторида аргона HArF, однако «подержать в руках» это соединение не удается: уже при очень низких температурах оно распадается. Зато вы можете подержать в руках сам аргон — им заполняют электрические лампочки накаливания (только не надо ломать лампочку — можно пораниться!). Аргон не реагирует с раскаленным металлическим волоском лампочки и хорошо отводит от него тепло.
Мы получили электронную формулу аргона. Рассмотрим электронные формулы двух других благородных элементов с зарядом ядра 10 и 36 — неона и криптона. В их атомах содержится соответственно 10 и 36 электронов. Используя рис. 2-8 и правила заполнения электронных уровней получим:

Итак, электронные формулы этих благородных газов показывают, что неон имеет заполненный 2-й внешний уровень ( n = 2), а криптон — заполненный 4-й внешний уровень (n = 4). На каждом таком полностью заполненном уровне находится по 8 электронов.
** Внимательный читатель может возразить, что внешняя оболочка криптона 36Kr, строго говоря, не является заполненной, поскольку свободны 4d- и 4f-орбитали. Действительно, правильнее говорить только о завершенных 4s и 4p-подуровнях криптона.
Чтобы полностью заполнить 4-й уровень, следующие за криптоном элементы вынуждены перед 4d- и 4f-орбиталями заполнить сначала более «низкие» (по энергии) 5s- и 6s-подуровни. В результате элемент, имеющий, например, полный набор 4d-электронов, должен обязательно иметь еще и 5s-электроны. Такой элемент имеет пока незавершенный 5-й уровень.
Причины необычайной устойчивости атомов с полностью заполненными s- и p-подуровнями до сих пор не совсем ясны. Нам полезно воспринять этот очень важный факт как известный химикам из природы, из опыта. В дальнейшем завершенность или незавершенность внешних уровней атомов позволит нам оценить многие химические свойства элементов.

Отметим, что каждый заполненный внешний электронный уровень благородных элементов содержит (s 2 + p 6 ) то есть 8 электронов. Логично предположить, что именно заполненные внешние электронные уровни являются причиной химической инертности благородных элементов, поскольку все другие элементы имеют частично незаполненные внешние (s + p) электронные уровни.
Но тогда логично выглядит и другое предположение: химические свойства «не благородных» элементов связаны с их стремлением завершить свои внешние электронные оболочки. Это предположение подтверждается многочисленными фактами и получило название правила октета (восьмерка — октет).
Образно говоря, атомы элементов «любят» наряжаться в электронные одежды благородных газов. Они стремятся создавать завершенные внешние электронные уровни (оболочки) из 8 электронов, отдавая свои электроны другим атомам или, наоборот, принимая электроны других атомов. Такой обмен электронами и вызывает все многообразие химических реакций.
Более строгая формулировка правила октета может выглядеть так:
Атомы элементов стремятся к наиболее устойчивой электронной конфигурации. Устойчивой является электронная конфигурация с завершенным внешним электронным уровнем из (s 2 + p 6 ), т.е. из октета электронов.
Только в одном случае завершенная оболочка может включать не 8, а 2 электрона. Благородный газ гелий (порядковый номер 2) имеет завершенную внешнюю оболочку из 2-х электронов (1s 2 ). Причина этого исключения вполне понятна: на самом нижнем уровне помещается только одна s-орбиталь, на которой можно разместить не более двух электронов. Физический смысл правила октета при этом не меняется. Суть его в том, что только завершенная электронная оболочка наиболее выгодна для атома, поскольку в этом случае электронная конфигурация обладает наименьшей энергией. Впрочем, иногда правило октета называют и «правилом октета-дублета».
С правилом октета тесно связаны донорные и акцепторные свойства атомов. Атомы — доноры электронов — склонны достигать октета, отдавая «лишние» электроны со своих внешних электронных уровней. Это атомы, у которых внешние электронные уровни только начинают застраиваться. Наоборот, атомы-акцепторы электронов легче достраивают свои внешние уровни до октета, принимая на них электроны других атомов. Обычно это элементы с уже почти завершенными внешними электронными уровнями. Как мы уже знаем, принимая или отдавая электроны, атомы могут превращаться в ионы. Например:
11Na (металл натрий: 1s 2 2s 2 2p 6 3s 1 ) — e — = 11Na + (ион натрия: 1s 2 2s 2 2p 6 — октет)
9F(газ фтор: 1s 2 2s 2 2p 5 ) + e — = 9F — (ион фтора: 1s 2 2s 2 2p 6 — октет)
Для атомов со сходными электронными оболочками донорные и акцепторные свойства — при прочих равных условиях — зависят еще и от удаленности внешнего уровня от ядра. У маленьких атомов с небольшим числом уровней внешний уровень подвергается заметному влиянию ядра (электроны удерживаются крепче), а у больших (тяжелых) элементов внешние уровни как бы отделены от ядра «экраном» из нижних электронных уровней, поэтому электроны внешнего уровня удерживаются слабее. При прочих равных условиях — то есть при одинаковом строении внешних уровней, более акцепторные свойства проявляют более «легкие» элементы.
Например, два близких по свойствам газа — фтор (порядковый номер 9) и хлор (порядковый номер 17) — имеют одинаковое строение внешних электронных уровней:
Фтор (F): 1s 2 2s 2 2p 5 ;
Хлор (Cl): 1s 2 2s 2 2p 6 3s 2 3p 5
Акцепторные свойства фтора выше, потому что его внешний электронный уровень находится ближе к ядру, чем у хлора. Это означает, что фтор (по сравнению с хлором) в химических реакциях ведет себя более «агрессивно» и легче заполняет свой внешний уровень до октета, забирая недостающий электрон у какого-либо другого элемента. Подтверждение этому факту мы уже знаем: существуют соединения фтора даже с благородными элементами ксеноном и криптоном, но до сих пор не известно соединений благородных газов с хлором.
Может возникнуть вопрос: почему наиболее акцепторные свойства проявляет все-таки фтор, а не водород? Ведь атом водорода самый маленький, он имеет наименьшее расстояние от ядра до электронной оболочки, а для ее завершения тоже нужен всего один электрон. Дело в том, что отсутствие электронов (как в ионе H + ) можно рассматривать как частный случай «завершенной» электронной оболочки. Поэтому частицы H + относительно устойчивы. Например, они присутствуют в растворах кислот (хотя и не в свободном виде, а в окружении молекул растворителя) и придают таким растворам кислый вкус. Следовательно, атому водорода часто выгоднее «отдать» свой единственный электрон, чем «забирать» чужой. Впрочем, акцепторные свойства атомов водорода все-таки заметно выше, чем, например, у атомов натрия. Мы еще вернемся к донорным и акцепторным свойствам в следующей главе при рассмотрении химической связи и окислительно-восстановительных свойств элементов.
Донорные и акцепторные свойства относительны. Донорные свойства элементов проявляются обычно в присутствии акцепторов, а акцепторные — в присутствии доноров.
Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах;
Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяют:
1. принцип наименьшей энергии;
2. правило Клечковского;
3. принцип запрета Паули;
4. правило Гунда.
Принцип наименьшей энергии:максимуму устойчивости системы соответствует минимум её энергии.
Следовательно, в соответствии с данным принципом электроны будут вначале располагаться на атомных орбиталях, имеющих минимальную энергию, в этом случае связь электронов с ядром наиболее прочная и атомная система находится в состоянии максимальной устойчивости.
В  многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергии орбиталей усложняется.
многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергии орбиталей усложняется.
Порядок возрастания энергии атомных орбиталей в сложных атомах описывается правилом Клечковского: при увеличении заряда ядра атома заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n+l), а при равных значениях суммы (n+l) – в порядке возрастания n.
Соответственно этому правилу подуровни выстраиваются в следующий ряд (рис. 2.4.): 1s 2 , емкость энергетического уровня составляет 2n 2 электронов, где n – соответствующее значение главного квантового числа.
Правило Гунда:устойчивому (невозбужденному) состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спинового числа их (│∑ms│) максимально.
Другими словами: заполнение орбиталей одного подуровня в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данном подуровне, заполняются орбитали вторыми электронами с противоположными спинами.
1.8. Электронные семейства элементов
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
1. s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными 1 являются электроны внешнего уровня.
2. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня.
3. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
4. f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.
В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28.
Заполнение орбиталей.
Наборы значений квантовых чисел для различных атомных орбиталей:
Квантовое число
Атомные орбитали
Количество
Обозначение
При заполнении электронами атомных орбиталей соблюдаются следующие три правила:
1. Принцип устойчивости (принцип минимальной энергии). Орбитали заполняются начиная с имеющих самую низкую энергию и далее в порядке её повышения. В этом случае энергия атома является минимальной, а устойчивость – максимальной.
энергетическая последовательность легко может быть описана при помощи правила суммы двух первых квантовых чисел n+l. Это правило носит название правила Клечковского (1951 г.):
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа n и побочного (орбитального) квантового числа l, т.е. n+l, имеет меньшее значение.
Например, орбиталь 4s, для которой n+l = 4+0 = 4, заполняется раньше, чем орбиталь 3d, где сумма n+l = 3+2 = 5.
При равенстве сумм ниже по энергии находится орбиталь с меньшим значением главного кантового числа. Так, орбиталь 3d имеет более низкую энергию, чем 4р.
Обычный порядок заполнения атомных орбиталей:
Порядок заполнения электронами электронных оболочек





Периодическая система элементов и структура электронной оболочки атомов
Как указывалось выше, элементы в периодической системе располагаются в последовательности возрастания Z от 1 до 105, но эта закономерность еще не объясняет природы периодичности. Современная формулировка периодического закона гласит:
Периодическое изменение свойств элементов зависит от периодического повторения подобных структур электронной оболочки атомов.
Следовательно, в основе конструкции периодической системы лежит структура атомов. Если исходить из положения, что в атоме электроны стремятся занять наиболее низкие энергетические уровни и подуровни, то последовательность их заполнения должна быть такой: уровней — 1, 2, 3, 4, 5, 6, 7; подуровней — s, р, d, f: в целом — 1s, 2s2p, 3s3p3d, 4s4p4d4f, 5s5p5d5f . 6s6p6d . 7s7p .
Действительно, именно в такой последовательности заполняются уровни и подуровни в атомах элементов от 1 до 18 включительно, составляющих три первых (коротких) периода в системе (табл. 21).
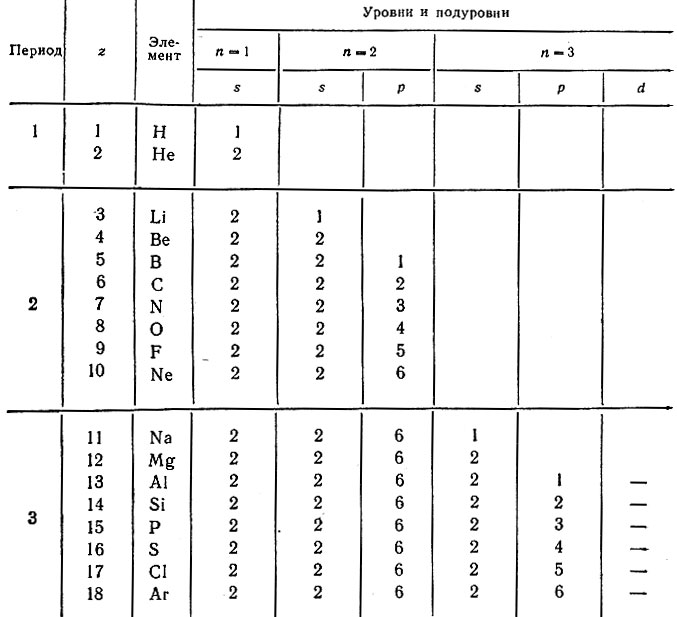
Таблица 21. Распределение электронов в атомах элементов 1-, 2- и 3-го периодов системы
Периоды начинаются элементами, в атомах которых на новом уровне появляется первый s-электрон (водород и щелочные металлы), а заканчиваются атомами благородных газов, содержащих на внешнем уровне два s-электрона (Не), два s- и шесть p-электронов (Ne, Аr). Первый период включает два элемента, а второй и третий периоды — по восьми элементов. Если бы все электронные уровни состояли из двух подуровней (s 2 p 6 ), то число элементов в любом периоде должно было быть только 8 = 2 + 6 и это соответствовало бы идеальной восьмиклеточной таблице периодической системы.
У атома 18-го элемента-аргона все подуровни, кроме 3d-подуровня, полностью заполнены. У атома следующего за ним девятнадцатого элемента — калия, казалось бы, должен заполняться электроном 3d-подуровень, а в действительности, как мы уже знаем, заполняется 4s-подуровень. Это объясняется тем, что некоторые подуровни различных уровней имеют близкие энергетические характеристики (рис. 7). К таким подуровням относятся: 4s- 3d, 5s — 4d, 6s — 5d — 4f и 7s — 6d — 5f. Для этих подуровней характерна своеобразная энергетическая «конкуренция», обусловленная притяжением электронов к ядру и отталкиванием его всеми остальными электронами.
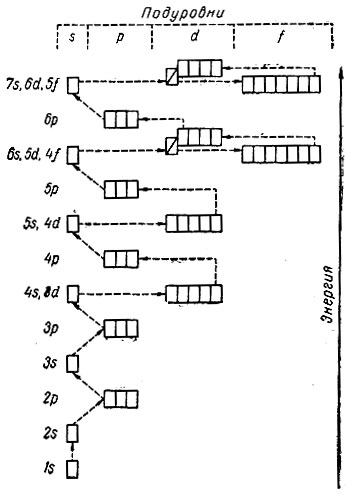
Рис. 7. Энергетические характеристики подуровней
Электрону атома калия энергетически выгоднее расположиться на 4s-подуровне. В атоме кальция (Z = 20) два электрона также помещаются на том же подуровне. Только с атома 21-го элемента — скандия начинает заполняться пропущенный ранее 3d-подуровень (табл. 22). Известно, что максимально на d-подуровне может разместиться 10 электронов, следовательно, полностью этот подуровень заполнится лишь у атома цинка (Z = 30). От 31 до 36-го элементов в атомах идет заполнение 4р-подуровня. В связи с тем, что в 4-м периоде происходит заполнение не только 4s- и 4p-подуровней, но и 3d-подуровня, число элементов в нем возрастает до 18. В 4-м уровне остаются незаполненными 4d- и 4f-подуровни.
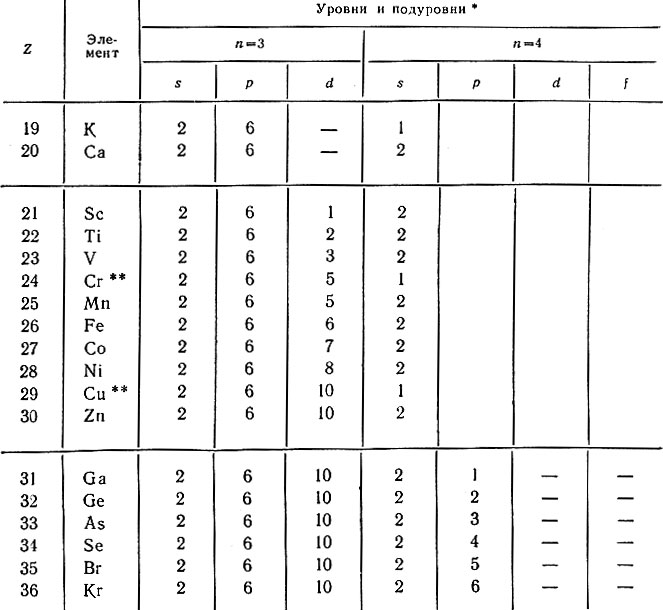
Таблица 22. Распределение электронов в атомах элементов 4-го периода
* (Уровни n = 1 и n = 2 в таблице не показаны, так как они у всех атомов построены одинаково (1s 2 2s 2 p 6 ).)
** (Отмечены случаи аномального заполнения подуровней; во внешнем подуровне не два, а только один электрон (см. стр. 72).)
Аналогичное построение имеет 5-й период, содержащий также 18 элементов от 37 (рубидия) до 54-го (ксенона). У атомов элементов этого периода первые четыре уровня построены одинаково (1s 2 2s 2 2p 6 3s 2 3d 10 3p 6 4s 2 4p 6 ). Однако у атомов первых двух элементов этого периода — рубидия и стронция — происходит заполнение не 4d-подуровня, а 5s-подуровня, затем, начиная с иттрия, пополняется пропущенный ранее 4d-подуровень и только с индия начинает заполняться 5p-подуровень (табл. 23). У шести элементов данного периода наблюдается аномальное заполнение подуровней в их атомах, а именно: Nb, Mo, Ru, Rh, Ag имеют на внешнем уровне по одному электрону, а у атома Pd на 5s-подуровне электроны отсутствуют. У атома этого элемента число электронных уровней равно четырем, хотя он находится в 5-м периоде (единственное исключение в системе!). У атомов элементов этого периода не заполняются электронами 4f-, 5d- и 5f-подуровни.
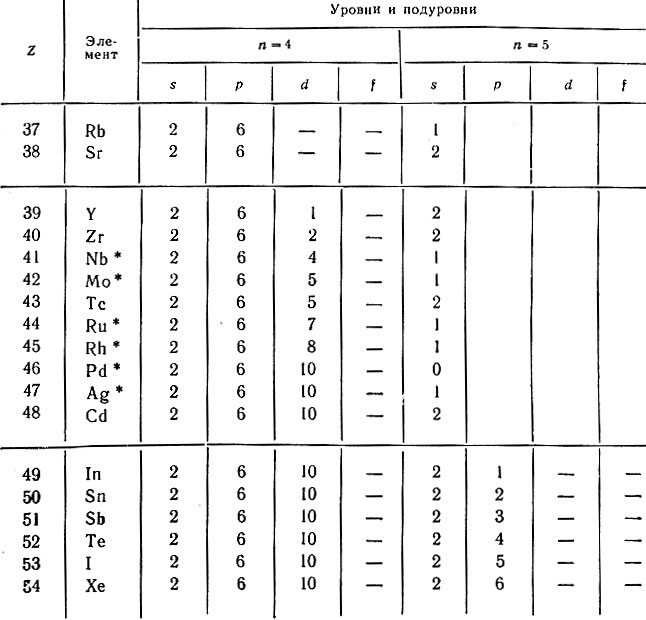
Таблица 23. Распределение электронов в атомах элементов 5-го периода
* (Отмечены случаи аномального заполнения электронами подуровней.)
В 6-м периоде в атомах 55 и 56-го элементов застраивается 6s-подуровень одним и двумя электронами соответственно. У следующего 57-го элемента (лантана) один электрон помещается на 5d-подуровне (на рис. 7 эта орбиталь отмечена диагональной чертой), а с 58 до 71-го элемента постепенно заполняется пропущенный 4f-подуровень (f 14 ), причем 5й-электрон сохраняется только в атомах Gd (Z = 64) и Lu (Z = 71). Затем у атомов с 72-го по 80-й элемент достраивается ^-подуровень с аномальным заполнением у Pt и Аu, а с 81-го по 86-й -6p-подуровень. Следовательно, в результате заполнения четырнадцатью электронами 4f-подуровня в шестом периоде число элементов увеличивается до 32 (табл. 24).
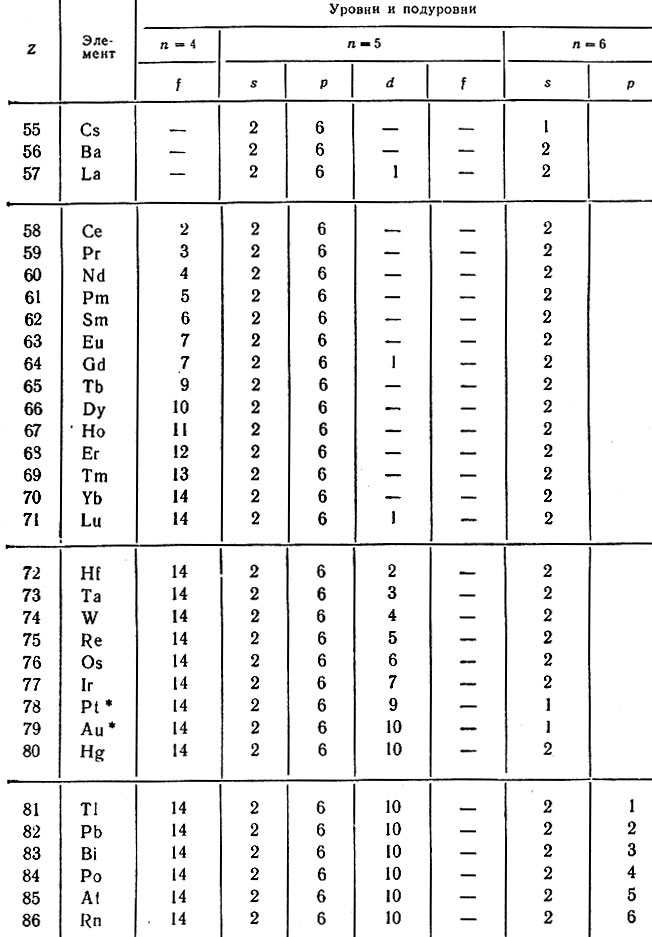
Таблица 24. Распределение электронов в атомах элементов 6-го периода
* (Отмечены случаи аномального заполнения электронами подуровней.)
Седьмой период полностью не завершен, в нем известно пока только 19 элементов — от 87 до 105-го. Конструктивно этот период построен аналогично шестому периоду. Для тория еще не доказано наличие в его атоме 5f-электронов * : для него принята электронная конфигурация 6d 2 7s 2 . Элементу с Z = 104, полученному в лаборатории ядерных исследований в г. Дубне, руководимой академиком Г. Н. Флеровым, предложено название «курчатовий» (Кu) в честь известного советского физика И. В. Курчатова. Недавно в СССР и в США получен искусственно элемент с Z = 105. Его предложено назвать «ганий» — На (США) и «нильсборий» — Ns (СССР); окончательное название еще не утверждено.
* (Американскому ученому Кенингему удалось обнаружить 5f-электрон в ионе Th 3+ .)
Схема последовательности заполнения электронных уровней и подуровней позволяет составить принципиальную конструкцию таблицы периодической системы как классификации атомов по структуре их электронных оболочек (табл. 25).
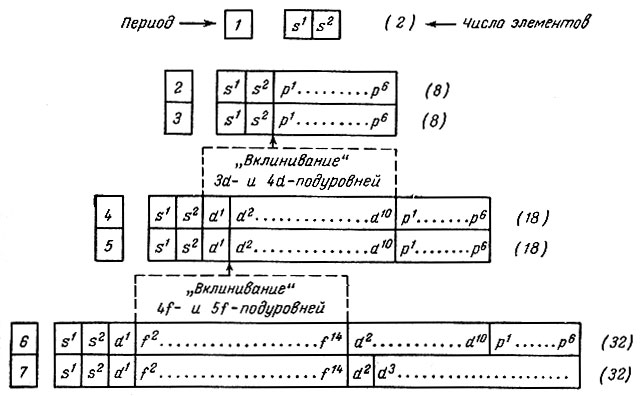
Таблица 25. Схема конструкции периодической системы на основе структуры электронных оболочек атомов
Так как максимальная емкость периодов соответствует 32 элементам, то естественной формой таблицы периодической системы должна быть 32-клеточная (табл. 26), включающая 105 элементов.
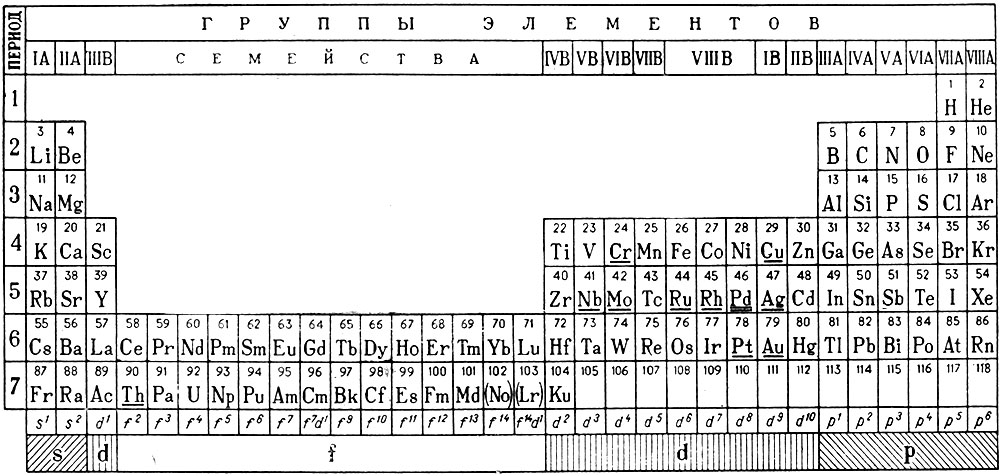
Таблица 26. Периодическая система химических элементов Д. И. Менделеева (длиннопериодный вариант)
В таблице, как и в графике на плоскости, следует различать два направления: горизонтальное (периоды) и вертикальное (группы).
В периодической системе семь периодов. Номер периода указывает на число электронных уровней в атомах элементов (исключение для 46-го элемента отмечено выше). Все периоды, кроме первого, попарно содержат одинаковое число (X) элементов, которое можно определить по формулам, предложенным В. М. Клечковским:
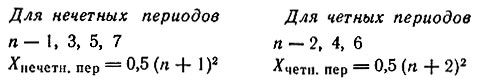
В системе четко выделяются четыре типа элементов: s-, p-, d- и f-элементы, характеризующиеся не только сходством свойств элементов, принадлежащих одной группе (сходство по вертикали), но и рядом специфических свойств, общих для всех элементов данного типа (сходство по горизонтали). В каждом периоде первые два элемента относятся к s-типу (их всего 14, в том числе Н и Не). Во втором — шестом периодах последние шесть элементов принадлежат к р-типу (их 30). В четвертом — седьмом периодах располагаются d-элементы (их 33); в шестом — седьмом периодах заняли надлежащее место 28 f-элементов (см. табл. 26).
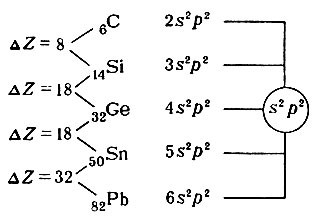
В вертикальном направлении в группах расположены элементы-аналоги как по химическим свойствам, так и по структуре электронной оболочки атомов. Так как элементы-аналоги последующих периодов отстоят от элементов-аналогов предыдущих периодов на 8, 8, 18, 18 и 32 места, то через столько же элементов должно происходить периодическое «повторение» свойств. Например, в группе IV А атомы элементов углерода, кремния, германия, олова и свинца различаются числом энергетических уровней, но не различаются по распределению электронов на внешнем уровне, т. е. обладают одинаковой конфигурацией внешнего электронного уровня, — s 2 p 2 . В системе нет больше ни одного элемента, в атоме которого была бы указанная конфигурация внешнего электронного уровня.
Группы нумеруются двояко: группы s- и p-элементов римскими числами с литерой «А», а d-элементов — с литерой «В». Номер группы соответствует числу внешних или валентных электронов в атоме. Элементы f-типа — лантаноиды (58-71) и актиноиды (90-103) — характеризуются переменной валентностью, первые от двух до четырех, а вторые — от двух до семи (недавно в СССР получены семи валентные соединения нептуния и плутония). Они представляют два семейства и не отнесены к каким-либо группам. Элементы групп кобальта и никеля, проявляющие валентность от двух до шести, но не выше, включены условно в VIIIB-группу, хотя для этого нет убедительных оснований. Их иногда, вместе с элементами группы железа, называют триадами, так как в каждом периоде (4-, 5- и 6-м) в VIIIB-группу отнесено по три элемента. Для элементов «нулевой» группы принято обозначение VIIIA, так как за последние десять лет синтезировано большое число соединений этих элементов и в некоторых из них валентность достигает значения восьми. К этой группе относят и гелий, хотя, в отличие от других благородных газов, он является элементом s-типа.
В атомах d-элементов, как правило, на внешнем уровне содержится по два электрона за исключением тех элементов, которые в таблице подчеркнуты одной чертой. У последних наблюдается энергетически выгодный «провал» одного электрона с внешнего уровня на d-подуровень внутреннего соседнего уровня, что происходит при достройке этого подуровня до пяти или десяти электронов, т. е. до состояния, когда все орбитали заняты каждая одним (половина максимальной емкости) или когда они заняты каждая парой электронов (максимальная емкость подуровня). В атоме палладия (Z = 46) происходит «двойной провал» электронов — его символ в таблице подчеркнут двумя чертами. Поэтому у атомов d-элементов — аналогов электронная структура валентных подуровней не всегда тождественна. Так, У атомов элементов VIB-группы Cr, Mo, W она различна: 3d 5 4s 1 , 4d 5 5s 1 и 5d 4 6s 2 , соответственно. Этим различием в строении электронной оболочки обусловлены некоторые особенности их химических свойств, но характеристичная валентность, определяемая суммарным числом электронов s-, d-типа, у всех атомов одинакова и равна шести.
Структура валентных электронных уровней у атомов элементов IIB-, IIIB-, IVB- и VIIB-групп одинакова.
Об особенностях структуры электронных оболочек атомов лантаноидов и актиноидов будет сказано ниже.
Таким образом, становится ясным, что идеальная последовательность заполнения электронами оболочки атома по возрастающему значению главного квантового числа n в действительности распространяется лишь на элементы первых трех периодов от водорода (Z = 1) до аргона (Z = 18). Эта последовательность полностью отвечает принципу Паули и получила название идеальной схемы заполнения.
Начиная с 19-го элемента — калия, несмотря на то что в его атоме 3d-подуровень остается вакантным, последний электрон; занимает 45-подуровень. Этот же подуровень заполняется вторым электроном в атоме кальция (Z = 20). Только с атома 21-го элемента — скандия — начинает заполняться вакантный 3d-подуровень (табл. 27).

Таблица 27. Заполнение электронами внешних подуровней атомов элементов с Z, равным 18, 19, 20 и 21
Реальная схема заполнения электронных оболочек атомов, начиная с калия, подвергает сомнению доминирующую роль главного квантового числа n.
Советский ученый В. М. Клечковский предложил распределять электроны в атоме по сумме главного (n) и орбитального (l) квантовых чисел, т. е. по (n + l), названной им группой или состоянием.
С увеличением порядкового номера электроны в атоме заполняют квантовые уровни последовательно, начиная с групп уровней с меньшим значением суммы (n + l) до групп с большим значением:
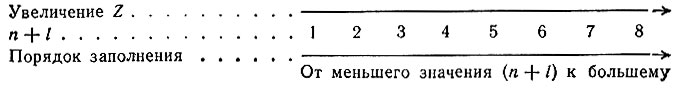
В пределах одной группы (n + l) подуровни заполняются от меньшего значения n и большего значения l к большему значению n и меньшему значению l. Например, для группы (n + l) = 5 порядок заполнения электронами подуровней выполняется в направлении слева направо:
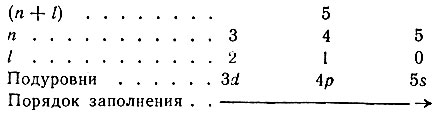
В атомах элементов отдельно взятого периода происходит заполнение s-подуровня со значением (n + l), равным номеру периода, а всех остальных подуровней со значением (n + l), на единицу большим номера периода:

На основании этих элементарных правил В. М. Клечковского определена последовательность заполнения электронами подуровней в атомах всех элементов:
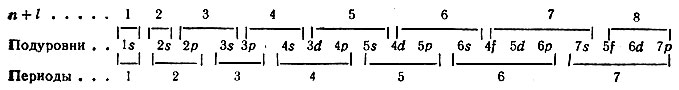
Учитывая максимальную емкость подуровней s 2 , p 6 , d 10 , f 14 , получим следующие числа элементов в периодах: 2, 8, 8, 18, 18, 32 и 32. Эти числа могут быть найдены и по формулам В. М. Клечковского, о чем упоминалось раньше.
В. М. Клечковский предложил формулу для определения порядкового номера элемента Zl, в атоме которого появляется первый электрон с данным орбитальным квантовым числом l. Используя ее применительно к двум первым электронам (2) Zl, заполняющим данный подуровень в атомах, автор по формуле
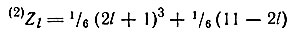
установил, что такими элементами являются 2Не, 6С, 22Ti, 58Ce. Действительно, в атомах этих элементов появляются первые два s(He), два p(С), два d(Ti) и два f(Се) электрона. Особенно важно это для церия, так как этим было подтверждено, что в его атомах содержатся два f-электрона, а не один, как предполагали раньше.
Однако нахождение Zl есть лишь частный случай более общей задачи о связи порядкового номера (Z) с числом электронов (Ni), занимающих в невозбужденном атоме уровни с данным орбитальным квантовым числом. Нахождение начала (ах) и конца (bх) заполнения электронами данного подуровня сводится к определению координат точек (рис. 8), отвечающих определенным значениям Z(ax), Z(bx) и Nl, где Nl = (bx) — (ах) — суммарное число электронов в данном подуровне. Пользуясь системой из двух уравнений, отдельно для четных и нечетных значений х (х = 1, 2, . 7), Клечковский показал, что можно легко вычислить значения порядковых номеров тех элементов, в промежутке между которыми должен заполняться в атоме подуровень с данным l (l = 0, 1, 2, 3). Уравнения для четных х:
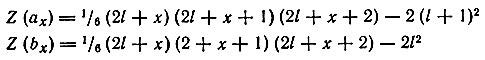
Уравнения для нечетных х:
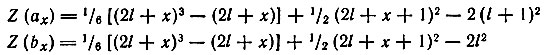
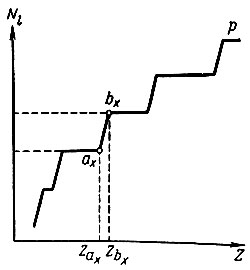
Рис. 8. Координаты начала и конца заполнения подуровней электронами
Вычисленные по этим формулам и фактические значения Z вполне удовлетворительно согласуются (табл. 28).
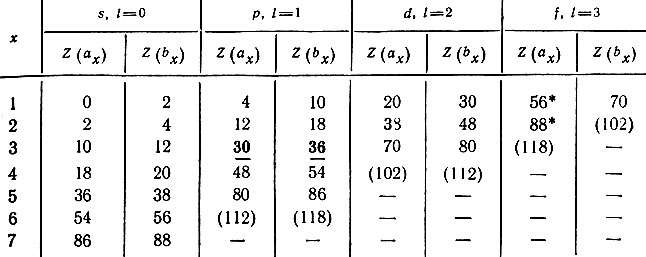
Таблица 28. Граничные значения Z при данном l по В. М. Клечковскому
Любая пара соседних чисел показывает границы комплектования электронами определенного подуровня в атомах. Например, числа 30 и 36 (они набраны жирным шрифтом) означают, что первый р-электрон появляется в атоме следующего 31-го элемента — галлия, а полное заполнение р-подуровня шестью электронами заканчивается в атоме 36-го элемента — криптона.
Числа, отмеченные звездочкой, обнаруживают несоответствие между вычисленными и фактическими значениями. Первые f-электроны появляются в атомах 58 и 91-го элементов, а не 57 и 89-го, непосредственно следующих за 56 и 88-м. Истинная последовательность заполнения электронами подуровней в 6-м уровне такова — 6s 2 5d 1 4f 14 5d 2-10 6p 6 и отличается от последовательности 6s 2 4f 14 5d 10 6p 6 , найденной В. М. Клечковским.
Кроме того, как было показано выше, известны отступления от закономерного заполнения электронами подуровней, вследствие «провала» электронов (см. подчеркнутые символы в табл. 26).
Если раньше считали, что энергетическое состояние электрона в многоэлектронном атоме определяется значением главного квантового числа n, то в работах В. М. Клечковского было показано:
«. В периферической части электронной оболочки многоэлектронных атомов вместе с увеличением числа экранирующих электронов зависимость энергетического уровня от орбитального квантового числа l настолько возрастает, что в ряде случаев уровни с большим n, но малым l оказываются энергетически выгоднее уровней с меньшим значением n, но большим l» * .
* (Клечковский В. М., Распределение атомных электронов и правило последовательного заполнения (n + l)-групп, Атомиздат, 1968, стр. 23.)
Правило В. М. Клечковского — правило последовательного заполнения электронами (n + l)-групп — является серьезным теоретическим обоснованием периодической системы Д. И. Менделеева.
Важное значение для химии имеет понятие о конфигурационном индексе (2εк), впервые введенное В. М. Клечковским. Величина εк — характеризует число электронов, недостающих до полного заполнения всех начатых заполняться (n + l)-групп в основном состоянии атома. Рассмотрим величину εк для атома бора, имеющего электронную конфигурацию 1s 2 2s 2 2p 1 :

Среди других элементов периодической системы аналогами бора будут те, которые имеют конфигурационный индекс, равный 7. К таковым относятся: алюминий, галлий, индий и таллий, которые вместе с бором составляют IIIA-группу элементов.
До сих пор принималось, что химические аналоги являются в то же время электронными аналогами. Для большинства элементов это утверждение является справедливым, так как у их атомов электронная конфигурация одинакова (различны только значения главных квантовых чисел). Однако у ряда химических аналогов электронные конфигурации могут различаться. К таким элементам, как мы уже знаем, относятся хром (3d 5 4s 1 ), молибден (4d 5 5s 1 ) и вольфрам (5d 4 6s 2 ). Несмотря на то что электронные конфигурации указанных атомов отличаются, они являются химическими аналогами. Это подтверждается тождественным значением их конфигурационного индекса — 14.
Из 105 известных элементов В. М. Клечковский отмечает 18 отклонений от его правила, определяющего электронную конфигурацию атомов и, соответственно, значение конфигурационного индекса. Например, конфигурационный индекс лантана и актиния принят равным 31 с учетом того, что в их атомах имеется по одному f-электрону, а в действительности эти атомы не содержат электронов данного типа: их электронная конфигурация — d 2 s 1 .
Установление сложной структуры электронной оболочки атомов позволило выявить новые, ранее неизвестные характеристики и свойства: например, энергию ионизации, сродство к электрону, радиус атома и др.
